INTRODUÇÃO À QUÍMICA ORGÂNICA
Sabemos que o principal representante dos compostos aromáticos é o benzeno, embora existam vários outros compostos aromáticos. Para um determinado composto ser considerado aromático é preciso que o mesmo obedeça alguns critérios: ser planar, cíclico, nuvem ininterrupta de elétrons pi e estar de acordo com a regra de Ruckel (4n + 2 = número de elétrons pi). Considerando os dois compostos abaixo, 1 - ciclo-octatetraeno e 2 - ciclopentadienila, assinale a alternativa correta.
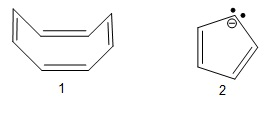
O composto 1 não pode ser considerado aromático pois não é planar apesar de abedecer a regra de Ruckel.
O composto 2 é aromático e seu valor de "n" calculado pela regra de Ruckel é igual a 1.
O composto 1 pode ser considerado aromático e o composto 2 não é aromático.
Os dois compostos são aromáticos por obedecerem a todos os critérios de aromaticidade.
Ambos os compostos abedecem a regra de Ruckel.
As moléculas orgânicas deram origem aos primeiros seres unicelulares em nosso planeta. Além da sua importância na origem da vida, os compostos orgânicos constituem até hoje, a parte fundamental de todo o ciclo da vida existente da terra. Existem vários tipos de compostos orgânicos e dentre eles temos os hidrocarbonetos que são compostos que contêm apenas átomos de carbono e hidrogênio. Dentre os tipos de hidrocarbonetos existentes assinale a alternativa que apresenta uma característica de um alcano.
Os alcanos apresentam fórmula geral CnH2n+2.
Os alcanos apresentam fórmula geral CnHn.
Os alcanos possuem ligações duplas.
Os alcanos apresentam hibridação sp.
Os alcanos apresentam hibridação sp2.
Com base na estrutura apresentada a seguir, apresente o nome oficial segunda as regras da IUPAC, descriminando corretamente as isomerias geométricas envolvidas.
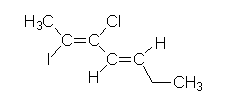
(2Z,4E)-2-iodo-3-cloro-2,4-heptadieno
(2Z,4E)-3-cloro-2-iodo-2,4-heptadieno
(2E,4Z)-2-iodo-3-cloro-2,4-heptadieno
(2E,4E)-3-cloro-2-iodo-2,4-heptadieno
(2Z,4Z)-3-cloro-2-iodo-2,4-heptadieno
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
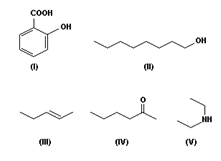 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido orto-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-2-ona; dietilamina
ácido para-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-5-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; trans-pent-3-eno; hexan-5-ona; dietilamida
ácido orto-hidroxibenzóico; octan-1-ol; cis-pent-2-eno; hexan-2-ona; dietilamida
ácido 2-hidroxibenzóico; octan-1-ol; cis-pent-3-eno; hexan-2-ona; dietilamina
É comum na natureza a existência de compostos de função mista, ou seja, estruturas que apresentam simultaneamente mais de um grupo funcional em sua estrutura.
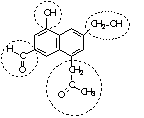 Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina
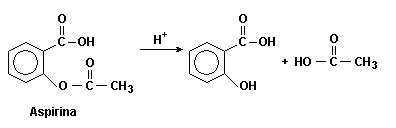
Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:

O composto 1 não pode ser considerado aromático pois não é planar apesar de abedecer a regra de Ruckel.
O composto 2 é aromático e seu valor de "n" calculado pela regra de Ruckel é igual a 1.
O composto 1 pode ser considerado aromático e o composto 2 não é aromático.
Os dois compostos são aromáticos por obedecerem a todos os critérios de aromaticidade.
Ambos os compostos abedecem a regra de Ruckel.
As moléculas orgânicas deram origem aos primeiros seres unicelulares em nosso planeta. Além da sua importância na origem da vida, os compostos orgânicos constituem até hoje, a parte fundamental de todo o ciclo da vida existente da terra. Existem vários tipos de compostos orgânicos e dentre eles temos os hidrocarbonetos que são compostos que contêm apenas átomos de carbono e hidrogênio. Dentre os tipos de hidrocarbonetos existentes assinale a alternativa que apresenta uma característica de um alcano.
Os alcanos apresentam fórmula geral CnH2n+2.
Os alcanos apresentam fórmula geral CnHn.
Os alcanos possuem ligações duplas.
Os alcanos apresentam hibridação sp.
Os alcanos apresentam hibridação sp2.
Com base na estrutura apresentada a seguir, apresente o nome oficial segunda as regras da IUPAC, descriminando corretamente as isomerias geométricas envolvidas.

(2Z,4E)-2-iodo-3-cloro-2,4-heptadieno
(2Z,4E)-3-cloro-2-iodo-2,4-heptadieno
(2E,4Z)-2-iodo-3-cloro-2,4-heptadieno
(2E,4E)-3-cloro-2-iodo-2,4-heptadieno
(2Z,4Z)-3-cloro-2-iodo-2,4-heptadieno
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido orto-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-2-ona; dietilamina
ácido para-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-5-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; trans-pent-3-eno; hexan-5-ona; dietilamida
ácido orto-hidroxibenzóico; octan-1-ol; cis-pent-2-eno; hexan-2-ona; dietilamida
ácido 2-hidroxibenzóico; octan-1-ol; cis-pent-3-eno; hexan-2-ona; dietilamina
É comum na natureza a existência de compostos de função mista, ou seja, estruturas que apresentam simultaneamente mais de um grupo funcional em sua estrutura.
 Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
Os alcanos apresentam fórmula geral CnH2n+2.
Os alcanos apresentam fórmula geral CnHn.
Os alcanos possuem ligações duplas.
Os alcanos apresentam hibridação sp.
Os alcanos apresentam hibridação sp2.
Com base na estrutura apresentada a seguir, apresente o nome oficial segunda as regras da IUPAC, descriminando corretamente as isomerias geométricas envolvidas.

(2Z,4E)-2-iodo-3-cloro-2,4-heptadieno
(2Z,4E)-3-cloro-2-iodo-2,4-heptadieno
(2E,4Z)-2-iodo-3-cloro-2,4-heptadieno
(2E,4E)-3-cloro-2-iodo-2,4-heptadieno
(2Z,4Z)-3-cloro-2-iodo-2,4-heptadieno
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido orto-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-2-ona; dietilamina
ácido para-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-5-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; trans-pent-3-eno; hexan-5-ona; dietilamida
ácido orto-hidroxibenzóico; octan-1-ol; cis-pent-2-eno; hexan-2-ona; dietilamida
ácido 2-hidroxibenzóico; octan-1-ol; cis-pent-3-eno; hexan-2-ona; dietilamina
É comum na natureza a existência de compostos de função mista, ou seja, estruturas que apresentam simultaneamente mais de um grupo funcional em sua estrutura.
 Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:

(2Z,4E)-2-iodo-3-cloro-2,4-heptadieno
(2Z,4E)-3-cloro-2-iodo-2,4-heptadieno
(2E,4Z)-2-iodo-3-cloro-2,4-heptadieno
(2E,4E)-3-cloro-2-iodo-2,4-heptadieno
(2Z,4Z)-3-cloro-2-iodo-2,4-heptadieno
A IUPAC - União Internacional de Química Pura e Aplicada busca de tempos em tempos uma revisão das regras de nomenclatura para nomear de forma sistemática os compostos orgânicos. Essa sistematização é importante devido ao grande número de compostos orgânicos existentes. É importante que pelo nome, tenha perfeita condição de identificar a função orgânica, posição da função e insaturações, número de carbonos, enfim, determinar corretamente a estrutura do composto.
 Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
Considerando as regras de nomenclatura recomendadas pela IUPAC, os nomes dos compostos de (I) a (V), acima representados, são, respectivamente:
ácido orto-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-2-ona; dietilamina
ácido para-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-5-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; trans-pent-3-eno; hexan-5-ona; dietilamida
ácido orto-hidroxibenzóico; octan-1-ol; cis-pent-2-eno; hexan-2-ona; dietilamida
ácido 2-hidroxibenzóico; octan-1-ol; cis-pent-3-eno; hexan-2-ona; dietilamina
É comum na natureza a existência de compostos de função mista, ou seja, estruturas que apresentam simultaneamente mais de um grupo funcional em sua estrutura.
 Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
ácido orto-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-2-ona; dietilamina
ácido para-hidroxibenzóico; octan-1-ol; trans-pent-2-eno; hexan-5-ona; dietilamina
ácido 2-hidroxibenzóico; octan-1-ol; trans-pent-3-eno; hexan-5-ona; dietilamida
ácido orto-hidroxibenzóico; octan-1-ol; cis-pent-2-eno; hexan-2-ona; dietilamida
ácido 2-hidroxibenzóico; octan-1-ol; cis-pent-3-eno; hexan-2-ona; dietilamina
É comum na natureza a existência de compostos de função mista, ou seja, estruturas que apresentam simultaneamente mais de um grupo funcional em sua estrutura.
 Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Quais funções orgânicas estão destacadas na fórmula estrutural acima:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
Fenol, Álcool, Aldeído e Éster
Fenol, Álcool, Aldeído e Cetona
Fenóis e Aldeídos
Alcoóis, Ácido Carboxílico e Cetona
Fenóis e Ácidos Carboxílicos
Os compostos orgânicos, quando em meio aquoso, podem ou não apresentar solubilidade em água. Quando são solúveis, transferem suas propriedades para o meio, conferindo alterações das propriedades e até mesmo do pH da solução. Alguns compostos podem gerar propriedades ácidas, como os ácidos carboxílicos. Considere os ácidos carboxílicos abaixo:
I – Cl3C-CO2H
II – CH3-CO2H
III – CH3-CH2-CH2-CO2H
IV – HCO2H
A opção que representa corretamente a ordem crescente de acidez é:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
III, I, II, IV.
I, IV, II. III.
IV, II, III, I.
I, III, IV, II.
III, II, IV, I.
Os carbocátions, importantes intermediários em reações orgânicas, reagem com nucleófilos por:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
Apresentarem geometria trigonal planar.
Apresentarem carbono com hibridização sp2.
Serem obtidos por clivagem heterolítica de ligação química.
Apresentarem carbono quiral.
Serem ácidos de Lewis.
Um alceno simples sofre reação de adição eletrofílica com vários eletrofílos, levando a formação de compostos saturados. Quando um alceno sofre a reação de adição de um haleto de hidrogênio o produto da reação será um haleto de alquila e essa reação de adição pode acontecer em duas etapas. Sobre essas etapas, podemos afirmar que:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
A segunda etapa ocorre com a adição lenta de um íon positivo ao carbocátion.
A segunda etapa ocorre com a adição rápida do íon haleto negativo ao carbocátion carregado com carga positiva.
A segunda etapa ocorre com a adição do próton ao alceno para formar uma espécie intermediária chamada carbocátion.
A primeira etapa ocorre com a adição rápida de um íon haleto ao carbocátion.
A primeira etapa ocorre com a adição dos elétrons ao alceno para formar uma espécie intermediária chamada carbocátion.
Os carbocátions são classificados de acordo com o número de substituintes que estão ligados ao carbono com a carga positiva. Sendo assim carbocátion primário possui apenas um substituinte alquila ligado ao carbono de carga positiva, carbocátion secundário possui dois substituintes ligados e carbocátion terciário possui três substituintes ao carbono com carga positiva. Sendo assim, podemos afirmar que a estabilidade do carbocátion:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.
A aspirina, medicamento usado como analgésico, antitérmico e anti-inflamatório, quando estocada durante um longo período de tempo, pode sofrer hidrólise na presença de água e calor. Nesta situação, o frasco contendo o medicamento fora do prazo de validade apresenta odor igual ao do vinagre.
Dado: Reação de hidrólise da aspirina

Com base no exposto, na equação química e nos conhecimentos sobre o tema, analise as afirmativas.
I. A hidrólise de uma molécula de aspirina produz 2 moléculas de ácidos carboxílicos.
II. O odor de vinagre no frasco é devido à formação do ácido acético.
III. O grupo -OH está na posição "meta" na molécula do ácido salicílico.
IV. Os ácidos acético e salicílico são isômeros de cadeia.
São corretas as afirmativas contidas em:
Aumenta com o aumento de substituintes ao carbono com carga positiva.
Aumenta com o aumento de substituintes ao carbono com carga negativa.
Aumenta com o menor número de substituintes ao carbono com carga positiva.
O carbocátion possui sempre a mesma estabilidade.
Diminui com o aumento de substituintes ao carbono com carga positiva.